contents area
주간건강과질병
detail content area
2018년도 질병관리본부 기관생명윤리위원회 운영 결과
- 작성일2019-05-16
- 최종수정일2019-09-10
- 담당부서생명과학연구관리과
- 연락처043-249-3070
2018년도 질병관리본부 기관생명윤리위원회 운영 결과
질병관리본부 국립보건연구원 유전체센터 생명과학연구관리과
이호동, 손순영, 한리나, 손일룡*
*교신저자 : iyson@korea.kr, 043-249-3070
이호동, 손순영, 한리나, 손일룡*
*교신저자 : iyson@korea.kr, 043-249-3070
Abstract
The operational results of the Institutional Review Board (IRB) of the Korea Centers for Disease Control and Prevention, 2018
Lee Ho-dong, Son soonyoung, Han Rina, Son Ilyong
Division of Life Science Research Management, Center for Genome Science, KNIH, KCDC
The Institutional Review Board (IRB) of the Korea Centers for Disease Control and Prevention (KCDC) has operated under the Bioethics and Safety Act to protect the rights, safety, and welfare of human subjects. It has mainly reviewed the research proposals related to human subjects, human derivatives, embryonic stem cell lines, and bio-banking. The Secretariat, established in the Division of Life Science Research Management, oversees operations of the IRB per standard operating guidelines. The Secretariat supports IRB works establishing protective measures for vulnerable research subjects, and preparing ethical guidelines for researchers. In 2018, the IRB held 12 sessions for six regular and six fast-track reviews, and went through a total of 124 proposals, including nineteen paper reviews. To promote the awareness of bioethics and safety among researchers, the IRB has conducted two kinds of educational programs: 67 completed off-line training course and 8,271 completed on-line training course. In addition, the IRB distributed the revised standard operating guidelines and a new guide-book for major bioethics and regulations that researchers ought to follow. The Secretariat is striving for the efficient operation of IRB. Keywords: Institutional Review Board, Bioethics, Research Subjects, Humans, Ethical guideline
Keywords: Institutional Review Board, Bioethics, Research Subjects, Humans, Ethical guideline
들어가는 말
질병관리본부 기관생명윤리위원회(이하 “기관위원회”, Institutional Review Board, IRB)는「생명윤리 및 안전에 관한 법률」(이하 “생명윤리법”)이 지향하는 목적, 즉 인간과 인체유래물 등을 연구하거나, 배아나 유전자 등을 취급할 때 인간의 존엄과 가치를 침해하거나 인체에 위해(危害)를 끼치는 것을 방지함으로써 생명윤리 및 안전을 확보하고 국민의 건강과 삶의 질 향상에 이바지하기 위해 운영하는 자율적이고 독립적인 위원회이다.
질병관리본부는 기관위원회의 운영과 행정을 지원하기 위하여 사무국을 설치하여 기관위원회 운영, 연구의 심의, 기관 내 연구자 대상 교육, 취약한 연구대상자 등의 보호 대책 수립 및 연구자를 위한 윤리지침 마련 등 기관위원회의 업무를 지원하도록 하고 있다. 현재 사무국은 사무국장인 생명과학연구관리과 부서장 외 업무담당 3인으로 구성되어 있다.
2018년 질병관리본부 기관위원회는 내부위원 10인과 외부위원 3인 등 총 13인의 정규위원으로 구성되어 보통 월 1회의 주기로 정규심의와 신속심의를 격월로 개최한다. 정규심의의 경우 생명과학 분야 외 전공자로서 외부위원 1인을 포함한 재적인원 과반수 위원의 출석으로 개회하고, 신속심의의 경우 내부위원 3인이 대면회의 또는 서면으로 심의한다.
정규심의는 기본적으로 모든 신규 연구계획을 대상으로 하며, 신속심의는 다년도 연구의 진행상황, 연구의 종료 및 신규 연구계획 중 연구대상자에게 미치는 위험이 낮다고 판단되는 연구 등을 대상으로 심의한다. 정규심의의 경우 회의 참석위원 과반수의 결과로 판정하며, 신속심의는 전원 의견일치의 경우로 정하고 의견일치가 어렵거나 필요시에는 정규 또는 신속 대면심의에서 판정한다.
심의 후 회의 내용 및 결과를 정리하여 심의한 위원들에게 회람하고, 이후 심의 신청부서에 승인기간, 심의의견 등을 포함한 심의결과를 통보한다. 승인기간은 심의일로부터 최대 1년간이며, 판정결과가 ‘조건부승인’인 경우 심의의견을 보완하여 사무국에 제출하면 이를 위원장 또는 간사가 확인하여 보완자료 제출일로부터 승인기간을 정하여 통보한다. ‘보완 후 재심의’ 판정의 경우는 해당 심의의견을 연구자가 보완하여 제출하면 정규 또는 신속 대면심의에서 판정한다. 또한 연구자는 심의결과를 통보받은 날 기준으로 14일 이내에 이의신청을 할 수 있다.
본 자료는 2018년 한 해 동안 기관위원회 운영 결과를 정리한 것으로 내부 연구자는 물론 기관위원회를 운영하고 있거나 설치할 예정으로 있는 외부기관 관계자가 참고할 수 있도록 정리한 것이다.
몸 말
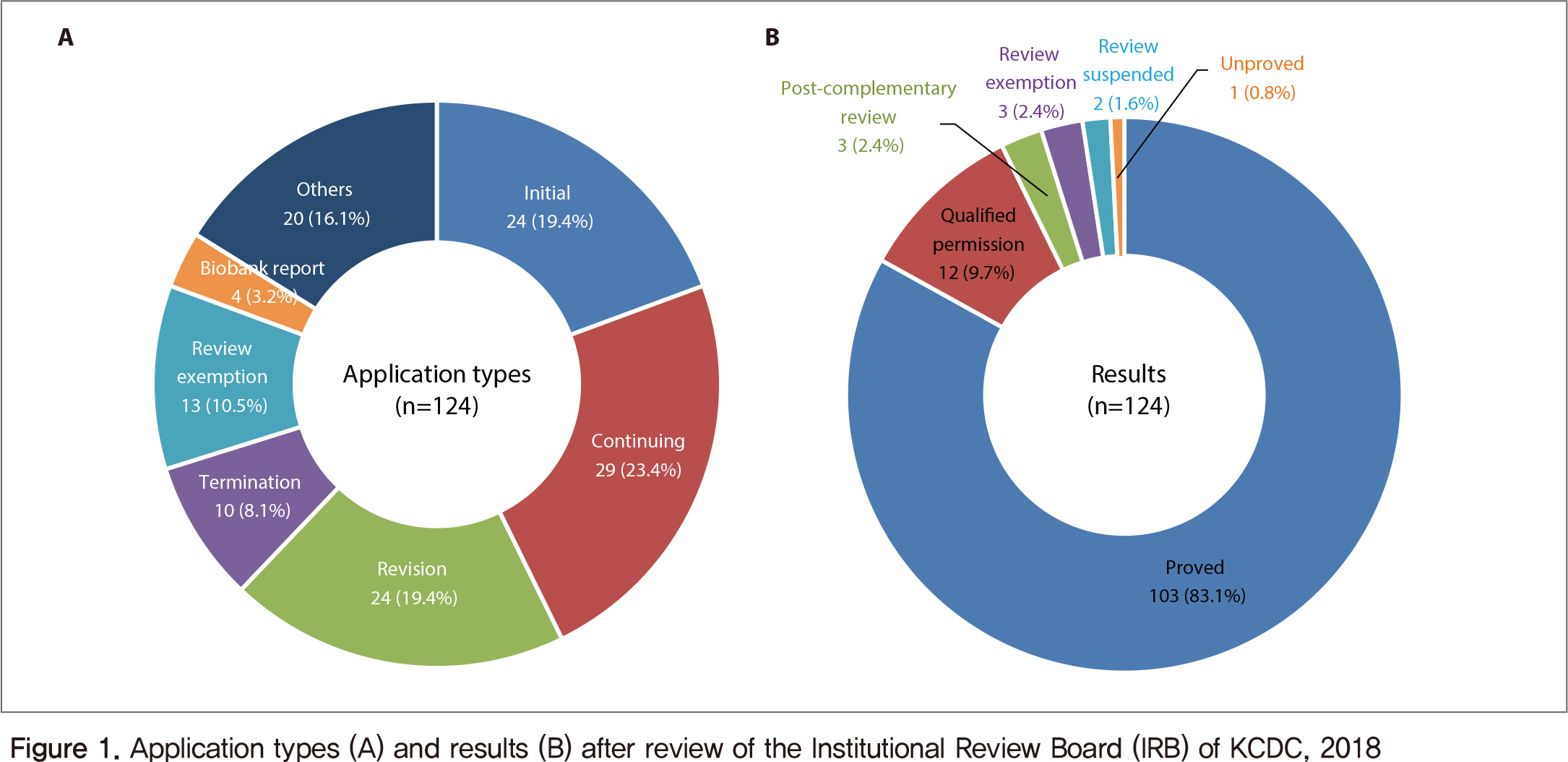
질병관리본부 기관위원회는 2018년에 정규심의 6회 및 신속심의 6회 등 총 12회의 대면회의와 총 19회 서면심의로 총 124건을 심의하였다(대면심의 104건 및 서면심의 20건).
총 124개의 심의 건 중 신규 연구계획 심의는 24건, 지속심의 29건, 계획변경 24건, 심의면제확인 13건, 종료심의 10건, 인체유래물은행 4건 및 그 외 사무국 운영 또는 활동 등의 심의 20건이었다. 심의결과는 승인 103건, 조건부승인 12건, 보완 후 재심의 3건, 심의면제 확인 3건, 심의보류가 2건 및 반려 1건이었다(Figure 1).
연구 유형별 분포(유형 중복 포함)는 인체유래물연구 70건, 인간대상연구 59건, 줄기세포주 이용 연구 5건, 인체유래물은행 4건, 기타 21건 등으로 전체 심의 건의 56.5%가 인체유래물연구, 47.6%가 인간대상연구의 유형을 포함하고 있었다.
센터별 심의신청 분포는 유전체센터 41건, 생명의과학센터 23건 및 감염병연구센터 21건 순으로 국립보건연구원 소속 3개 센터에서 신청한 심의 건이 전체 심의 124건의 68.5%(85건) 이었다. 그 외 감염병분석센터 17건, 감염병관리센터 11건, 질병예방센터 6건 및 긴급상황센터 5건 순이었다(Table 1).

연구자의 생명윤리 및 안전에 관한 지속적인 인식과 관심을 갖도록 연구자가 지켜야 할 주요 생명윤리 준수 수칙을 마련하였으며(‘18년 1월 제정), 기관 내 연구자를 대상으로 한국보건복지인력 개발원에서 주관하는 ‘생명윤리인식개선과정’의 교육을 2회 실시하였고(총 67명 이수), 인간대상연구 및 인체유래물 연구자를 위한 온라인 교육과정을 운영하였다(총 8,271명 이수). 그리고 진행 중인 14개 연구과제를 수행하는 각 연구부서를 방문하여 생명윤리 준수 여부를 상‧하반기 각 1회씩 점검하였다.
생명윤리 및 안전은 물론 연구과제 심의신청에 필요한 사항을 연구자에게 지원하기 위해 표준운영지침 개정판을 제작 배포하였고(’18년 2월 시행), ‘연구자를 위한 질병관리본부 기관생명윤리위원회 안내’ 책자를 제작·배포하였다. 또한, 4월부터 신속심의 체계에 서면심의를 처음으로 추가 도입하여 시행하였다.
맺는 말
2018년 기관위원회의 심의 건(12회, 124건)이 2017년(12회, 143건)과 비교하여 위원회 개최 횟수에 비해 심의 건이 감소하였으나, 2016년 심의(총 122건)와 비슷하며, 2017년에는 연구자가 인지하지 못한 종료보고 건을 안내하여 신청 건수가 늘어 난 것이었음으로 작년에 비해 심의 건수가 감소한 특이 사유가 있는 것은 아니었다.
2018년에 총 14개(상반기 8개, 하반기 6개)의 수행중인 연구과제 대상으로 연구계획 준수, 심의의견 이행 여부 등 10개 항목을 점검하여 지속적으로 주요 준수사항에 대한 안내와 함께 인식 개선에 도움을 주는 계기가 되었다.
2018년 한 해 동안 인간대상연구 및 인체유래물 연구자를 위한 온라인 교육과정의 이수자가 총 8,271명이었으며, 2014년 처음 개발‧운영된 이후 총 누적인원으로 약 3만여 명이 이수하였다. 당시 생명윤리법 개정에 따라 주요 법령사항과 개정사항을 주 내용으로 하여 운영된 이후, 현재 교육내용을 보완하여 개선한 새 온라인 교육과정을 2019년 상반기에 운영할 예정이다.
2018년 12월에는 생명윤리법 및 표준운영지침 중 기관위원회 운영, 심의체계, 기록 및 보관, 심의신청 서식 작성 등 연구자에게 필요한 주요 사항을 안내하기 위해 ‘연구자를 위한 질병관리본부 기관생명윤리위원회 안내’ 책자를 제작·배포하였다. 동시에 질병관리본부에 등록된 기관위원회의 해당 사무국에도 배포하여 공통사항 이외의 기관별 특성에 따른 내용을 자체 수정하여 활용할 수 있도록 편의를 도모하였다.
2018년 4월에는 기존 신속 대면회의 대상 안건 중 승인된 연구계획의 사소한 변경이 있는 연구계획, 지속 보고, 종료 보고, 인체유래물은행에서 자원을 제공받아 이용하는 연구 등 일부 안건을 서면으로 처리할 수 있도록 서면심의 체계를 도입하였다. 이로써 일부 사소한 심의사항에 대해 수시심의로 심의절차를 간소화하여 신청 후 결과통보까지 심의소요기간을 단축할 수 있게 하였다.
앞으로도 질병관리본부 기관위원회의 사무국 소속 직원들은 기관 내 지원을 바탕으로 효율적인 위원회 운영과 연구자 지원에 더욱 노력할 것이다. 2018년 1월에 제정된 생명윤리준수 수칙에 명시된 바와 같이 2019년 한 해에도 기관위원회 사무국의 운영과 관련하여 연구자와의 상호 협력을 기대한다.
참고문헌
1. 국가법령정보센터. 생명윤리 및 안전에 관한 법률, 시행령 및 시행규칙.
2. 질병관리본부. 질병관리본부 기관생명윤리위원회 표준운영지침. 2018.
3. 질병관리본부. 연구자를 위한 질병관리본부 기관생명윤리위원회 안내. 2018.
4. 질병관리본부. 기관생명윤리위원회 등록 및 등록변경 신청 안내. 2019.
 본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.
본 공공저작물은 공공누리 "출처표시+상업적이용금지+변경금지" 조건에 따라 이용할 수 있습니다.