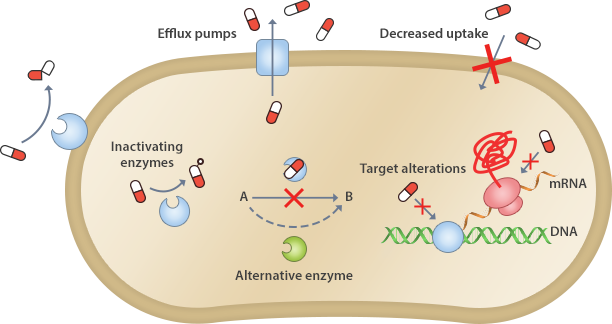
내성균의 항생제 내성기전
항생제의 내성 기전은 크게 항생제가 충분한 농도로 목표에 도달하지 못하게 하거나 항생제가 작용하는 대상을 변형시키거나 우회하게 하는 방법을 사용한다.
항생제 불활성화(Drug inactivation)
대표적으로 β-lactamase를 분비하는 세균은 β-lactam 고리를 가진 항생제를 파괴하여 항생제의 활성을 없앤다.
항생제 표적 부위의 변화(Alternation of target site)
항생제는 특정 효소나 세포 내 특정 부위를 표적으로 하는데, 표적의 특성이 바뀌면 내성을 갖게 된다. 예를 들어 일부 세균은 penicillin이 결합하는 penicillin 결합 단백질(PBP)를 변형시켜 내성을 갖게 하며, 또 일부 세균은 23S rRNA를 변형시켜 erythromycin과 chloramphenicol이 리보솜에 결합하는 것을 막아서 내성을 갖게 한다.
항생제의 세포 내 수송 저하(Decreased uptake)
막의 투과성을 낮추어 항생제가 세포 내로 들어가지 못하도록 막는다. 이러한 경우, 대상 항생제가 비교적 광범위하여 특이성이 없는 다중약제 내성일 가능성이 많다.
항생제를 즉시 세포 밖으로 배출(Efflux pump)
Tetracycline계, macrolide계, fluoroquinolone계 등의 항생제는 유출펌프에 의해 밖으로 배출되기도 한다. 이러한 경우, 대상 항생제가 비교적 광범위하여 특이성이 없는 다중약제 내성일 가능성이 많다.
새로운 생화학적 경로 개발(Alteration of metabolic pathway)
일부 항생제 내성 세균들은 외부로부터 이미 만들어진 엽산을 섭취할 수 있도록 대사과정을 변형시켜 엽산의 생합성을 필요로 하지 않는다. 따라서 엽산 생합성을 막는 sulfa계 항생제에 내성을 띈다.
- 출처
- ReAct website
- 항생제와 항생제 내성 슈퍼박테리아, 신은주, Ewha Med J 2017;40(3):99-103
- Manual of Clinical Microbiology 12thed(2019), p. 1242-1276
내성균 종류
지역사회감염, 의료관련감염에서 항생제 내성이 문제가 되는 균종은 다양하다. 이에 세계 보건기구(WHO)는 국제 항생제 내성 감시체계 GLASS(Global Antimicrobial Resistance Surveillance System)를 추진하고 있다. 우리나라도 8개의 권역의 종합병원을 감시기관으로 지정하여 환자로부터 분리된 주요 8종 (Escherichia coli, Klebsiella pneumoniae, Acinetobacter spp., Staphylococcus-aureus, Streptococcus pneumoniae, Salmonella spp., Shigella spp., Neisseria gonorrhoeae) 현황을 분석한 결과를 발표하였다. 뿐만 아니라 의료관련감염에서 위험요소인 내성균 중 다음의 6종을 법정감염병으로 지정하여 감시하고 있다.
Ⅰ. 메티실린 내성 황색포도알균(MRSA; Methicillin-resistant Staphylococcus-aureus)
Methicillin 및 그 밖의 β-lactam계 항생제에 내성을 나타내는 황색포도알균이다.
황색포도알균은 폐렴, 균혈증, 심내막염, 수술 창상 감염 등 병원에서 발생하는 감염증의 중요한 원인균이다. MRSA는 1970년대 말부터 영국과 호주 등지에서 새로운 유행균주가 등장한 이후 전 세계적으로 빈도가 증가하였다.
Ⅱ. 반코마이신내성황색포도알균(VRSA; Vancomycin-resistant Staphylococcus-aureus)
Vancomycin에 내성인 황색포도알균이다.
MRSA에 대한 감염이 생길 경우 glycopeptide계 항생제인 vancomycin이 고려되어 왔다. 1996년 vancomycin 중등도 내성을 보이는 황색포도알균이 일본에서 분리되고, 2002년 미국에서 vancomycin 고도내성 황색포도알균이 최초로 분리된 이후 내성균이 점차 보고되고 있다.
Ⅲ. 반코마이신내성장알균(VRE; Vancomycin-resistant enterococci)
Vancomycin을 포함한 glycopeptide 항생제에 내성을 보이는 장알균이다.
장알균은 피부, 점막, 위장관 등에 흔한 상재균이기 때문에 장알균이 동정된 경우 감염과 단순 집락화된 경우를 구분해야 한다. 장알균 중 실제 주요 감염을 일으키는 균종은 대표적으로 Enterococcus faecalis와 Enterococcus faecium이다. 일반적으로 장알균은 penicillin과 cephalosporin계 등 여러 항균제에 내성을 보이는데, 여기에 vancomycin 내성을 보이는 경우 약제 선택에 제한을 받게 된다.
Ⅳ. 다재내성녹농균(MRPA; Multidrug-resistant Pseudomonas aeruginosa)
Carbapenem계, aminoglycoside계, flouroquinolone계 항생제에 모두 내성을 나타내는 녹농균이다.
원내감염의 주요 원인균 중 하나인 녹농균은 폐렴, 균혈증 요로감염 등을 주로 일으킨다. 녹농균 감염에는 병합요법이 추천되는데 그 이유는 서로 다른 기전을 가진 항균제 사이에 상승작용을 기대할 수 있고, 항균 범위를 넓혀 초기 부적절한 항균 치료를 예방하며 내성의 발생을 예방하기 위함이다.
Ⅴ. 다재내성아시네토박터바우마니균(MRAB; Multidrug-resistant Acinetobacter baumanni)
Carbapenem계, aminoglycoside계, flouroquinolone계 항생제에 모두 내성을 나타내는 아시네토박터바우마니균이다.
녹농균과 더불어 병원 감염에서 문제가 되는 원인균 중 하나로 빠른 내성률의 증가 속도를 보인다.
Ⅵ. 카바페넴내성장내세균목균종(CRE; Carbapenem-resistant Enterobacteriales)
Carbapenem계 항생제에 내성을 나타내는 장내세균목 균종이다.
일반적으로 carbapenem은 치료의 마지막 대안으로 여겨왔으나 최근 종종 내성이 보고되고 있다. CRE는 내성을 일으키는 기전에 따라 carbapenem 분해효소 생성 장내세균(CP-CRE or CPE, Carbapenemase producing CRE)와 carbapenem 분해효소를 생성하지 않지만 carbapenem 내성인 장내세균(non-CP-CRE)으로 나눌 수 있다. 이중 CPE가 중요한데, 그 이유는 carbapenemase를 생성하는 유전자가 플라스미드를 통해 세균 사이를 이동하며 내성을 전파시키기 때문이다.
균종별 검사대상 항생제와 결과 해석
-
Staphylococcus-spp.(포도알균)
Penicillin에 대해 감수성인 포도알균은 penicillin, cephem 및 carbapenem에 대해 모두 감수성을 나타낸다. Penicillin에 대하여 내성이지만 oxacillin에 대하여 감수성인 균주는 β-lactamase에 의해 파괴되는 penicillin에 대하여는 내성이지만, β-lactamase에 안정한 penicillin, β-lactamase inhibitor 병합제, 적절한 cephem, carbapenem 등에 대하여 감수성이다. Oxacillin에 대해 내성인 포도알균은 현재 쓰이는 모든 β-lactam 항생제에 대한 내성이다. 그러므로 포도알균에서 β-lactam 항생제에 대한 감수성 및 내성 여부는 penicillin과 oxacillin을 검사함으로써 알 수 있으며, 다른 penicillin β-lactam / β-lactamase inhibitor, cephem 또는 carbapenem에 대한 감수성 검사는 일반적으로 필요하지 않다.
Staphylococcus spp.에서 디스크확산법으로 methicillin에 대한 내성 검사를 실시할 때 cefoxitin 디스크를 사용한다. S. aureus의 경우 mecA 유전자로 인한 methicillin 내성을 검사하는데 oxacillin 디스크와 cefoxitin디스크의 결과는 동일하다. 그러나 cefoxitin 디스크의 억제대를 판독하는 것이 oxacillin 디스크의 경우보다 더 쉽기 때문이다. 더구나 S. lugdunensis는 반드시 cefoxitin디스크로 검사해야 한다.
-
Enterococcus spp.
Enterococcus spp.에서 cephalosporin, aminoglycoside, clindamycin과 trimethoprim-sulfametthoxazole은 비록 검사결과가 감수성일지라도 임상적으로 효과가 없는 항생제이기 때문에 감수성으로 보고하지 말아야 한다. 단, aminoglycoside에 대한 고도내성 검사는 예외이다.
1) Gentamicin 고도내성 선별검사
Gentamicin이 500 ug/mL 들어있는 BHI 한천배지에 0.5 McFarland standard로 맞춘 균액 10 uL를 접종하고 35°C에서 24시간 배양한 다음 균집락 수를 관찰한다. 균집락이 두 개 이상 자랐으면 내성으로 판정한다.
2) Streptomycin 고도내성 선별검사
Streptomycin이 2,000 ug/mL 들어있는 BHI 한천배지(BHI broth의 경우 1,000 ug/mL)에 0.5 McFarlandstandard로 맞춘 균액 10uL를 접종하고 35°C에서 24시간 배양한 다음 균집락 수를 관찰한다. 만일 증식하지 않았으면 24시간 더 추가로 배양한다. 균집락이 두 개 이상 자랐으면 내성으로 판정한다.
3) Vancomycin 내성 선별검사
Vancomycin이 6 ug/mL 들어있는 BHI 한천배지에 0.5 McFarland standard로 맞춘 균액 1~10 uL를 접종하고 35°C에서 24시간 배양한 다음 균집락 수를 관찰한다. 균집락이 두 개 이상 자랐으면 내성으로 판정한다. 간혹 이 배지에서 증식할 수 있는 자연내성(VanC형)을 갖는 enterococci인 E, galinarum과 E, casseliflavus를 감별하기 위하여 운동성 및 색소생성 여부를 관찰한다. 자연내성을 갖는 균종들은 vancomycin에 대한 MIC가 주로 8~16 ug/mL로서 병원감염관리의 대상이 되지 않는다.
Vancomycin에 대해 내성인 enterococci의 경우 chloramphenicol, erythromycin, tetracycline, rifampin에 대한 감수성 검사를 할 수 있으나, 감염전문의에게 자문을 구해야 한다.
-
Streptococcus pneumoniae
Pneumococcus에 의한 감염증을 치료하기 위하여 amoxicillin, ampicillin, cefepime, cefotaxime, ceftriaxone, cefuroxime, imipenem과 meropenem을 사용할 수 있다. 그러나 이 항생제들에 대한 디스크확산법이 확립되지 않았기 때문에 MIC를 측정해야 한다. 수막염 또는 균혈증과 같은 중증 감염증 환자의 혈액이나 척수액에서 분리된 S. pneumonisa는 penicillin의 MIC뿐만 아니라 cefotaxime, ceftriaxone 또는 meropenem에 대해 MIC를 측정해야 한다. 또한 이 균주는 vancomycin에 대하여 배지희석법이나 디스크확산법으로 반드시 검사한다.
-
Streptococcus spp.(pneumococcus 제외)
혈액 또는 뇌척수액 등 체액에서 분리된 viridans streptococci는 penicillin에 대한 MIC를 측정해야 한다. Penicillin에 대한 MIC가 4 ug/mL 이상이면 내성이고, 0.25~2 ug/mL 이면 중간, 0.12 ug/mL 이하이면 감수성이다. 디스크확산법에 의한 penicillin, ampicillin, levofloxacin, ofloxacin, daptomycin의 판정기준은 베타용혈 연쇄구균에만 적용된다. Viridans streptococci에서 디스크법에 의한 penicillin, ampicillin, oxacillin의 결과는 믿을 수 없다. 소변 등 요로에서 분리된 균주의 경우 erythromycin, chloramphenicol, clindamycin의 결과를 보고하지 않는다.
-
Extended-spectrum β-lactamase 양성그람음성간균
E. coli, Klebsiella pneumoniae, K. oxytoca, proteus mirabilis의 일부 균종에서 extended-spectrum β-lactamase(ESBL)를 생산한다. ESBL 양성 균주의 경우 비록 penicillin 및 cephalosporin 항생제와 aztreonam에 대하여 감수성 검사에서는 감수성일지라도 이 항생제들을 사용하여 감염증이 치료되지 않을 수 있다. 이 균주들의 extended-spectrum cephalosporin이나 aztreonam에 대한 억제대 직경의 범위는 감수성 균주들이 보이는 억제대 직경의 분포범위보다 좁기 때문에 디스크 확산법의 억제대 직경의 크기를 선별검사로 사용한다.
ESBL을 생성하는 균주의 억제대는 clavulanic acid를 추가했을 경우 넓어진다. ESBL을 생성하는 균주는 모든 penicillin 및 cephalosporin와 aztreonam에 대해 내성으로 보고해야 한다.
-
Pseudomonas aeruginosa와 non-Enterobacteriaceae
P. aeruginosa에서 carbenicillin에 대한 MIC가 123ug/mL 이하이면 내성으로 판정한다. P. aeruginosa 이외의 non-Enterobacteriaceae에서는 carbenicillin에 대한 MIC가 16ug/mL 이하이면 감수성, 32ug/mL 이면중간, 64ug/mL 이상이면 내성으로 판정한다.
P. aeruginosa에서 piperacillin-tazobactam에 대한 MIC가 614 ug/mL 이하이면 감수성, 128/4 ug/mL 이상이면 내성으로 판정한다. P. aeruginosa 이외의 non-Enterobacteriaceae에서는 piperacillin-tazobactam에 대한 MIC가 16/4 ug/mL 이하이면 감수성, 32/4-64/4 ug/mL 이면 중간, 128/4 ug/mL 이상이면 내성으로 판정한다.
P. aeruginosa에서 colistin 에 대한 MIC가 2 ug/mL이하이면 감수성, 4 ug/mL 이면 중간, 8 ug/mL 이상이면 내성으로 판정한다. Acinetobacter spp.에서는 colistin에 대한 MIC가 2 ug/mL 이하이면 감수성, 4 ug/mL이상이면 내성으로 판정한다.
-
Haemophilus spp.
생명을 위협하는 감염증(수막염, 균형증, 후두개염, 안면봉소염) 환자의 혈액과 척수액에서 분리된 H. influenzae는 ampicillin, 3세대 cephalosporin 중 하나, chloramphenicol과 meropenem에 대한 감수성 검사를 반드시 실시해야 한다.
Haemophilus spp.로 인한 호흡기감염증을 치료하기 위하여 경험적으로 amoxicillin/clavulanic, azithromycin, clarithromycin, cefaclor, cefprozil, loracarbef, cefdinir, cefixime, cefpodoxime 또는 cefuroxime axetil을 경구투여한다. 이 항생제에 대한 감수성 검사결과는 환자를 치료하는데 도움이 되지 않을 수 있다. 그러나 역학조사를 하거나 내성 균주의 출현을 잠시하는데 도움이 된다.
Amoxicillin의 항균 효과를 예측하기 위하여 ampicillin에 대한 감수성 검사결과를 이용한다. Ampicillin과 amoxicillin에 대해 내성인 H. influenzae는 대부분 TEM-type β-lactamase를 생성한다. 따라서 대부분의
경우 β-lactamase 검사를 하면 ampicillin과 amoxicillin에 대한 내성여부를 알 수 있다.
-
Neisseria spp.
N. meningitidis에서 ampicillin, penicillin과 rifampicin에 대한 디스크법의 결과는 믿을 수 없다. 이 경우 MIC를 측정해야 한다.
N. gonorrhoeae에서 β-lactamase 양성 균주는 penicillin, ampicillin과 amoxicillin에 대해 내성이다.
그러나 β-lactamase 검사는 다른 기전으로 인한 penicillin에 대한 내성을 알아낼 수 없다. 염색체 내성을 갖는 균주는 디스크법 또는 MIC를 측정해야 penicillin 내성을 알 수 있다.
-
Salmonella와 Shigella
Salmonella와 Shigella spp.는 ampicillin, quinolone계 중 하나(ciprofloxacin)와 trimethoprim-sulfa-methoxazole(cotrimoxazole)에 대하여만 항생제 감수성 검사를 실시한다. 우리 나라에서는 ampicillin과 cotrimoxazole에 대해 모두 내성인 균주가 간혹 출현하고, 소아에서는 ciprofloxacin을 사용할 수 없기 때문에 cefixime을 추가로 검사하는 것이 좋을 것이다. Salmonella의 경우 장외 분리균주(extraintestinal isolate)는 chloramphenicol과 3세대 cephalosporin계인 cefoperazone, cefotaxime, ceftizoxime과 ceftriaxone 중 하나를 선택하여 위의 3가지 항생제와 함께 추가로 감수성 검사를 시행한다.
-
무산소성 세균
일반적으로 무산소성 세균의 항생제 감수성 검사는 통상적으로 실시할 필요가 없다. 그러나 뇌농양, 심내막염, 골수염, 관절감염증, 균혈증 등에서 분리한 무산소성 세균은 항생제 감수성 검사가 필요하다. 따라서 무산소성 세균은 항생제 감수성 검사를 위하여 진담검사의학과는 환자 병증에 대하여 임상의사와 긴밀한 정보를 교환해야 한다.
- 출처
- 함께서울 건강포털
- 국가 항생제 내성 관리대책(2021-2025), 정책정보포털
- 항생제 내성의 국내 현황 및 대책, 송재훈, 대한내과학회지: 제 77 권 제 2 호 2009
- 다재내성균감염관리지침. 질병관리청(2012)
- http://www.incodom.kr/%ED%95%AD%EC%83%9D%EC%A0%9C_%EB%82%B4%EC%84%B1#h_bb0cf9b3036b1158f3d82b877eb81310
- https://www.who.int/initiatives/glass/
- Establishment of the South Korean national antimicrobial resistance surveillance system, Kor-GLASS, in 2016. EuroSurveill. 2018;23(42);pii=1700734
- Antimicrobial resistance of major clinical pathogens in South Korea, May 2016 to April 2017: first one-year report from Kor-GLASS. EuroSurveill. 2018;23(42);pii=1800047
- 카바페넴 내성 장내세균: 최신지견과 치료전략, 이효진 & 이동건, J Korean Med Assoc 2018 April; 61(4):281-289
- 법정 감염병 진단검사 통합지침 제 2판, 질병관리청
- 항생제의 길잡이 제4판, 대한감염학회(2019)