Efforts are made to enhance the reliability of infectious disease diagnostic tests.
- Infectious disease diagnostic tests are the first step in epidemic response measures such as isolation and treatment, making accuracy essential..
- To this end, the Korea Disease Control and Prevention Agency is making various efforts to maintain and manage the diagnostic testing capabilities of public testing institutions for infectious diseases.
- Establishing Standard Operating Procedures (SOPs) for infectious disease laboratory testing methods
- Transferring verified standard testing method technology to local governments so that infectious disease diagnostic tests can be performed uniformly across the nation
- Conducting annual training and proficiency assessments on the transferred standard testing methods to manage testing accuracy
- Recognizing and managing laboratories with objectively proven capabilities in standard system operations as "National Standard Laboratories for Infectious Diseases" to promote the standardization of the infectious disease diagnostic testing system.
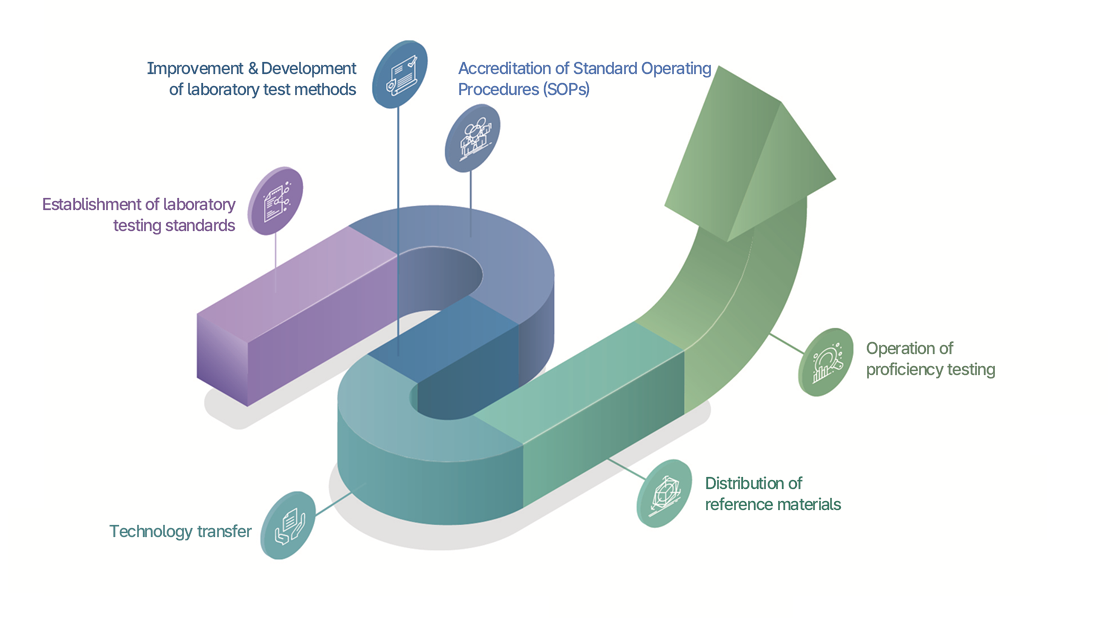
이 이미지는 진단검사 품질관리의 단계별 절차를 곡선형 화살표로 표현한 흐름도이다. ■ 시작 단계 - 진단검사 기준 제시: 검사 기준 및 표준 설정. - 검사법 개발: 실험실 검사법의 개선 및 개발. ■ 중간 단계 - 표준절차서 인증(SOPs): 검사 수행을 위한 표준운영절차를 마련하고 인증. - 기술이전: 개발된 기술을 관련 기관이나 실험실로 이전. ■ 심화 단계 - 표준물질 보급: 기준이 되는 표준물질을 배포하여 검사 신뢰성 확보. - 숙련도평가 운영: 검사기관의 숙련도 평가를 통해 품질 유지와 개선. ■ 종합 해석 전체 과정은 기준 수립 → 검사법 개발 → 절차 인증 → 기술 확산 → 표준물질 보급 → 숙련도평가 순으로 이어지며, 궁극적으로 실험실 진단검사의 신뢰성과 정확성을 보장하는 품질관리 체계임을 나타낸다.
- 01
Provision of laboratory testing standards based on scientific evidence
- 02
Establishment of SOPs for laboratory testing through validation
- 03
Technology transfer through training and assessments of test methods
- 04
Operation of proficiency testing for accurate laboratory testing
