contents area
유전자변형생물체국가안전관리
- 작성일2025-03-19
- 최종검토일2025-04-03
- 담당부서생물안전평가과
- 연락처043-719-8042
detail content area
보건의료용 유전자변형생물체
국민의 건강을 보호·증진하기 위한 용도로 사용되는 유전자변형생물체(LMO)*로 의약품‧의료기기용 제외
- 시험·연구용 유전자변형생물체, 농림축산업용 유전자변형생물체, 산업용 유전자변형생물체, 환경정화용 유전자변형생물체, 또는 해양수산용 유전자변형생물체를 제외한 화장품, 의약외품, 위생용품 등의 보건의료에 이용되는 유전자변형생물체
[ 보건의료용 유전자변형생물체의 예시 ]
보건의료용 유전자변형생물체의 안전관리
우리나라는 「유전자변형생물체의 국가간 이동 등에 관한 법률」에 따라 유전자변형생물체를 용도별로 정의하고 각 관계 중앙행정기관에서 소관 안전관리를 시행하며, 보건의료용 유전자변형생물체는 질병관리청에서 관리함
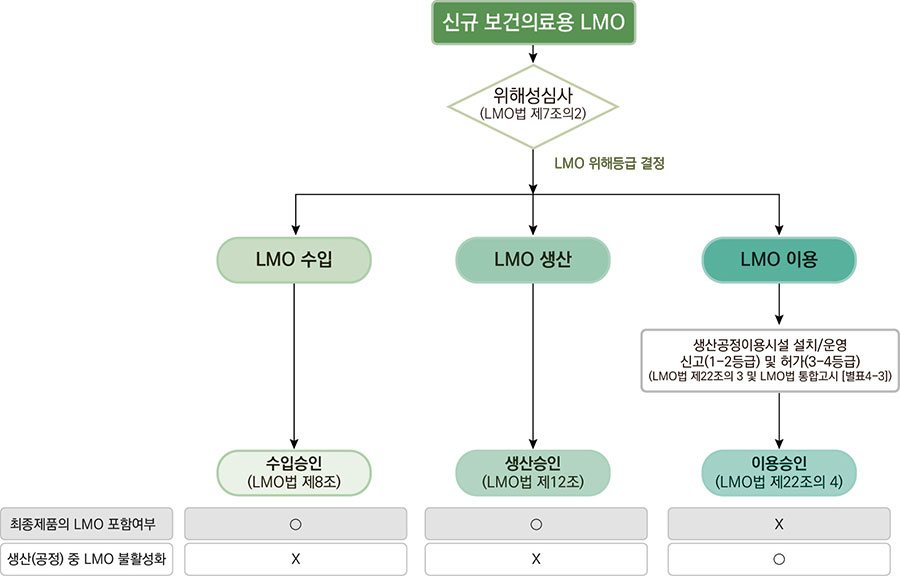
보건의료용 LMO를 수입하거나, 생산 또는 이용하기 위해서는 질병관리청의 사전 승인이 필요함
- 보건의료용 LMO의 수입, 생산, 이용 승인 신청 전에 질병관리청의 위해성심사를 받아야 함
- 질병관리청(수입 승인) - 국가관리가 필요한 시험연구용 LMO 수입
- 과학기술정보통신부(수입 신고) - 수입 승인사항 이외의 LMO
보건의료용 LMO의 ‘생산승인’과 ‘이용승인’은 관리·운영 상 개념적 차이가 있음
- 최종제품의 LMO 포함 여부에 따라 ‘생산승인’과 ‘이용승인’을 구분할 수 있음
- 생산(공정) 중 LMO가 불활성화되어 최종 제품에 LMO가 포함되지 않는 경우는 ‘이용승인’을 받아야 함
- 생산(공정) 중 LMO가 불활성화되지 않고, 최종 제품에 LMO가 포함되는 경우는 ‘생산승인’을 받아야 함
보건의료용 유전자변형생물체의 수입승인
제출서류
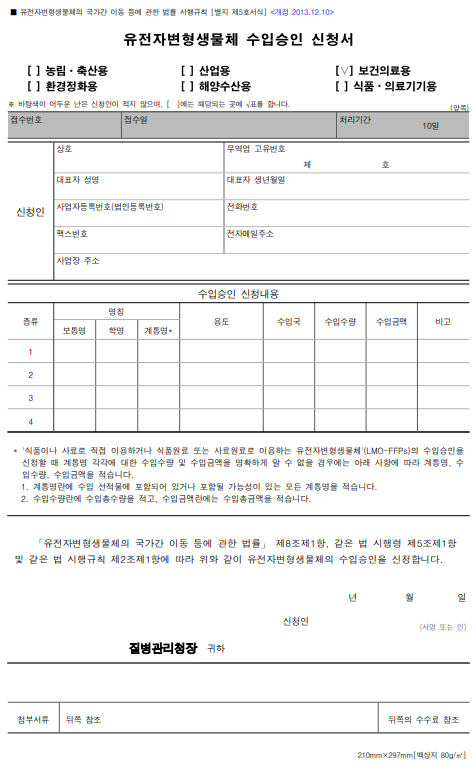
[보건의료용 유전자변형생물체의 수입승인 서류예시]
- ① 유전자변형생물체 수입승인 신청서
- ② 질병관리청이 발급한 위해성심사 승인결과서
- ③ 수입계약서(수입대행계약서 포함) 또는 주문서 사본
- ④ 유전자변형생물체 운반계획서
- ⑤ 유전자변형생물체 안전관리계획서
- ⑥ 유전자변형생물체 사용계획서
- ⑦ 정부 수입인지
- 행정 수수료용 발급(5만원)
- ⑧ 환경 방출용 유전자변형생물체 사전수입 동의서
※ 해당 서식은 자료실에 첨부함 [바로가기]
- 유전자변형생물체 안전관리 가이드
보건의료용 LMO 수입승인 사항의 변경
| 변경신고 | 변경승인 | |
|---|---|---|
| 범위 |
유전자변형생물체법 제8조제3항의
‘경미한 사항’에 해당할 경우 변경신고대상 ∙미생물이 아닌 LMO 수입수량(부피 또는 질량)의 1/100 이하 수량 변경 ∙수입자의 상호·주소 또는 연락처의 변경 |
∙‘경미한 사항’에 해당되지 않는 사항 |
| 제출서류 |
① 유전자변형생물체 수입승인사항 변경신고서 ② 변경신고에 해당함을 증빙하는 첨부서류 ③ 기 통지된 수입승인서 |
① 유전자변형생물체 수입승인사항 변경승인 신청서 ② 변경내용을 증명하는 서류 ③ 기 통지된 수입승인서 |
보건의료용 LMO 수입승인 신청 절차
- 신청서류: 수입승인 신청서에 제출 서류를 첨부하여 접수
- 제출방법: 서류(인쇄본) 1부를 포함하여 전자 공문 또는 우편으로 제출
※ 이메일로 제출시, 원본은 우편으로 발송 - 제출처: 질병관리청 생물안전평가과
- 처리 기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
보건의료용 유전자변형생물체의 생산승인
제출서류

- ① 유전자변형생물체 생산승인 신청서
- ② 질병관리청이 발급한 위해성심사 승인결과서
- ③ 유전자변형생물체 안전관리계획서
- 취급·보관 안전관리방안, 안전관리 인력
(취급자 및 관리책임자) 및 안전관리 설비(연구시설 신고확인서·허가서 등) 현황 등의 정보 기재
- 취급·보관 안전관리방안, 안전관리 인력
- ④ 정부 수입인지
- 행정 수수료용 발급(5만원)
※ 해당 서식은 자료실에 첨부함 [바로가기]
- 유전자변형생물체 안전관리 가이드
보건의료용 LMO 생산승인 사항의 변경
| 변경신고 | 변경승인 | |
|---|---|---|
| 범위 |
유전자변형생물체법 제12조제2항의
‘경미한 사항’에 해당할 경우 변경신고대상 ∙1/100을 초과하지 아니하는 범위 이내에서의 생산 수량의 변경 ※ 유전자변형미생물의 경우, 생산 수량의 변경은 경미한 사항에 해당하지 않음 ∙생산자의 상호·주소 또는 연락처의 변경 |
∙‘경미한 사항’에 해당되지 않는 사항 |
| 제출서류 | ① 유전자변형생물체 생산승인사항 변경신고서 ② 변경신고에 해당함을 증빙하는 첨부서류 ③ 기 통지된 생산승인서 |
① 유전자변형생물체 생산승인사항 변경승인 신청서 ② 변경내용을 증명하는 서류 ③ 기 통지된 생산승인서 |
보건의료용 LMO 생산승인 신청 절차
- 신청서류: 생산승인 신청서에 제출 서류를 첨부하여 접수
- 제출방법: 서류(인쇄본) 1부를 포함하여 전자 공문 또는 우편으로 제출
※ 이메일로 제출시, 원본은 우편으로 발송 - 제출처: 질병관리청 생물안전평가과
- 처리기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)
보건의료용 유전자변형생물체의 이용승인
제출서류

- ① 유전자변형생물체 이용승인 신청서
- ② 질병관리청이 발급한 위해성심사 승인결과서
- ③ 취급·보관 등에 관한 안전관리방안
- ④ 안전관리에 필요한 전문인력·설비의 현황
- ⑤ 정부 수입인지
- 행정 수수료용 발급(5만원)
※ 해당 서식은 자료실에 첨부함 [바로가기]
- 유전자변형생물체 안전관리 가이드
보건의료용 LMO 이용승인 사항의 변경
| 변경신고 | 변경승인 | |
|---|---|---|
| 범위 |
유전자변형생물체법 제22조의4 제2항의
‘경미한 사항’에 해당할 경우 변경신고대상
∙이용자의 성명(법인의 경우에는 법인명을 말함) ·주소 또는 연락처의 변경 |
∙‘경미한 사항’에 해당되지 않는 사항 |
| 제출서류 | ① 유전자변형생물체 이용승인사항 변경신고서 ② 변경신고에 해당함을 증빙하는 첨부서류 ③ 기 통지된 이용승인서 |
① 유전자변형생물체 이용승인사항 변경승인 신청서 ② 변경내용을 증명하는 서류 ③ 기 통지된 이용승인서 |
보건의료용 LMO 이용승인 신청 절차
- 신청서류: 이용승인 신청서에 제출 서류를 첨부하여 접수
- 제출방법: 서류(인쇄본) 1부를 포함하여 전자 공문 또는 우편으로 제출
※ 이메일로 제출시, 원본은 우편으로 발송 - 제출처: 질병관리청 생물안전평가과
- 처리기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)





