contents area
유전자변형생물체국가안전관리
- 작성일2025-03-19
- 최종검토일2025-04-03
- 담당부서생물안전평가과
- 연락처043-719-8042
detail content area
보건의료용 유전자변형생물체의 위해성심사
보건의료용 목적으로 LMO를 수입·생산·이용하고자 하는 자는 「유전자변형생물체 국가간 이동 등에 관한 법률」 제7조의2 제1항에 따라 질병관리청의 위해성심사 필수
- 유전자변형생물체의 위해성심사는 기존 종(유전자 변형되지 않은 숙주 생물체)과의 비교학적 분석을 통해 평가됨
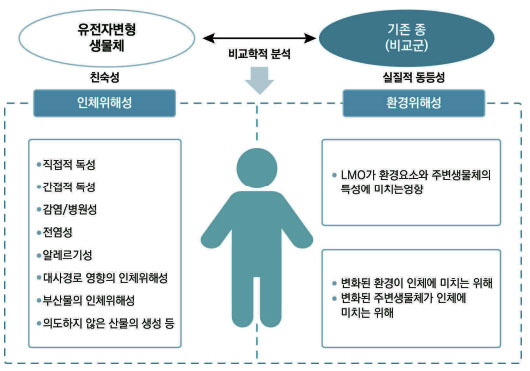
[유전자변형생물체의 위해성평가]
- 질병관리청(수입 승인) - 국가관리가 필요한 시험연구용 LMO 수입
- 과학기술정보통신부(수입 신고) - 수입 승인사항 이외의 LMO
보건의료용 유전자변형생물체의 위해성심사 절차
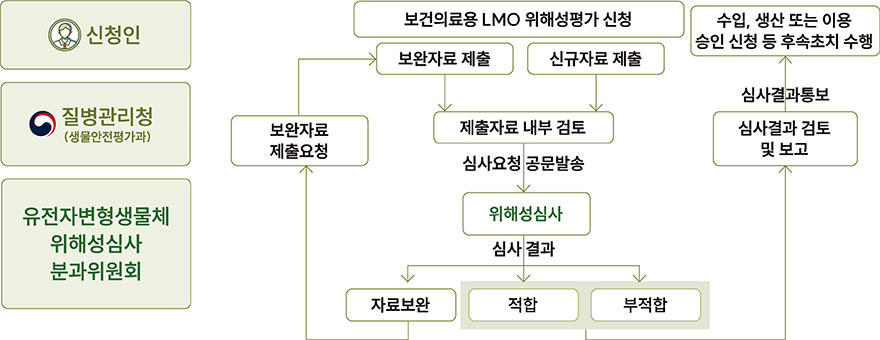
[보건의료용 LMO 위해성심사 절차]
- 질병관리청(수입 승인) - 국가관리가 필요한 시험연구용 LMO 수입
- 과학기술정보통신부(수입 신고) - 수입 승인사항 이외의 LMO
보건의료용 유전자변형생물체 위해성심사 제출 서류
- ① 유전자변형생물체 위해성심사신청서
- ② 위해성평가자료 제출표
- ③ 유전자변형생물체의 위해성평가자료
- ④ 위해성평가서 한글요약문
- ⑤ 제출자료에 대한 증빙자료(참고문헌, 표준품 등)
- ⑥ 정부 수입인지
- 행정 수수료용 발급(400만원)
※ 해당 서식은 자료실에 첨부함
[바로가기]
- 유전자변형생물체 안전관리 가이드
보건의료용 LMO 위해성심사 신청 시 제출하는 위해성평가자료는 「유전자변형생물체 국가간 이동 등에 관한 통합고시」 제5-2조에 따른 요건을 충족해야함
[ 위해성평가 제출자료의 요건 ]
보건의료용 LMO 위해성심사 신청 절차
- 신청서류: 유전자변형생물체 위해성심사신청서에 제출 서류를 첨부하여 접수
- 제출방법: 서류(인쇄본) 1부와 전자문서 12부를 포함하여 전자 공문 또는 우편으로 제출
※ 이메일로 제출시, 원본은 우편으로 발송 - 제출처: 질병관리청 생물안전평가과
- 처리기간(자료보완 기간이 있을 경우, 보완기간은 처리 기한에 포함되지 아니함)





