| 정의 | 치쿤구니야 바이러스(Chikungunya virus) 감염에 의한 급성 열성 질환 | ||
|---|---|---|---|
| 질병분류 | 제3급 감염병(질병코드: A92.0) | ||
| 병원체 |
토가바이러스과(Tokaviridae) 알파바이러스속(Alphavirus) 치쿤구니야 바이러스(Chikungunya virus) (양성 단일가닥 RNA 바이러스) |
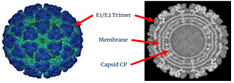
|
|
| 주요 백신항원 | Chikungunya structural polyprotein (C, E3, E2, 6k, E1) | ||
| 병원소 | 숲모기류 (흰줄 숲모기 Aedes albopictus or 이집트 숲모기 Aedes aegypti) | ||
| 감염경로 | 숲모기 -> 사람 | 치쿤구니야 바이러스에 감염된 매개모기에 물려 감염이 전파 (사람-모기-사람으로 전파), 수혈, 장기이식, 주사기 자상 등 혈액을 통한 전파 가능성 추정, 수직감염 사례 보고됨 | |
| 국내발생 | 최근 5년간 2018년 3건, 2019년 16건, 2020년 1건, 2022년 6건(잠정) 발생함 | ||
| 국외발생 | 최초보고 | 1952년 아프리카 탄지니아 마콘데 고원에서 첫 유행이 있었고 당시 환자의 혈청에서 치쿤구니야 바이러스를 처음으로 분리하였으며, 이후 사하라 이남 아프리카에서 유행함 | |
| 발생동향 |
(1963~2005년) 인도에서 14만 명 이상의 환자 발생 (2006~2007년) 아프리카, 아시아, 이탈리아 지역 환자 발생 (2009년) 인도네시아, 태국, 말레이시아에서 유행 보고 (2013년~) 캐리비안 지역, 북아메리카, 남아메리카 지역으로 확산 (2020년) 파키스탄, 인도, 브라질, 카리브해 지역에서 다수 보고 |
||
| 위험지역 | 아프리카 및 아시아 지역에서 주로 풍토적으로 발생하며, 특히 인도양 주변 국가 및 남동 아시아 지역이 위험지역으로 꼽히고 있음 | ||
| 해외유입 | 다수의 해외 유입 사례가 발생하였으며 특히, 동남아시아 방문 후 감염된 사례가 가장 많았음 | ||
| 잠복기 | 1~12일(평균 3~7일) | ||
| 임상 증상 |
|
||
| 치명률 | 사망률은 극히 낮으며 주로 고령에서 발생함 | ||
| 진단 | 검체(혈액, 체액 등)에서 특이 유전자 검출(Real-time RT-PCR) | ||
| 치료 | 전 세계적으로 상용화된 특이 치료제 없음, 증상에 따른 대증치료가 최선 | ||
| 예방 |
|
||
| 정의 | 니파바이러스 감염에 의한 급성, 열성 및 바이러스성 인수공통 전염병2) | ||
|---|---|---|---|
| WHO 질병분류 | ICD-10 B33.8(기타 명시된 바이러스성 질환) | ||
| 병원체 |
파라믹소비리데과(Paramyxoviridae) 헤니파바이러스속(Henipavirus) 니파바이러스(NIpah virus) (음성 단일가닥 RNA 바이러스) |
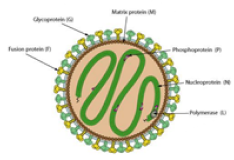
|
|
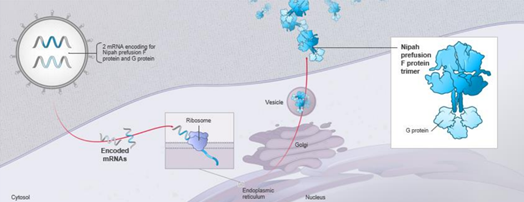
| 주요 백신항원 | Nipah virus glycoprotein (G, F) | ||
| 병원소 | 감염된 동물(Pteropodidae과 Pteropus속 과일박쥐, 돼지 등), 감염된 동물의 체액에 의해 오염된 식품, 직접 접촉한 환자 | ||
| 감염경로 | 바이러스에 감염된 자연계 병원소(과일박쥐, 돼지 등)와 직접 접촉, 환자 직접접촉 | ||
| 바이러스 감염 동물의 체액에 의해 오염된 식품(야자 수액 또는 과일 등) 소비 | |||
| 국내발생 | 국내 발생 없음 | ||
| 국외발생 | 최초보고 | 1998년 말레이시아에서 처음 확인됨 | |
| 발생동향 | 1998-1999년 말레이시아 순가이 니파 마을에서 처음으로 발생하여 그 이후, 방글라데시, 인도, 필리핀, 싱가포르 등 니파벨트 지역에서 산발적인 발병이 발생함3) | ||
| 위험지역 | 방글라데시, 인도, 말레이시아, 필리핀, 싱가포르 등이 있음 | ||
| 해외유입 | 국내 유입사례 없음 | ||
| 잠복기 | 약 4~14일 | ||
| 임상 증상 |
|
||
| 치명률 | 40-70% (유행 지역의 감시 역량에 따라 상이) | ||
| 진단 | 검체(혈액, 체액 등)에서 특이 유전자 검출(Real-time RT-PCR) 및 바이러스 항원-항체 반응 검사 | ||
| 치료 | 전 세계적으로 상용화된 특이 치료제 없음, 보존적 치료 실시 유행시 항바이러스제 리바비린(Ribavirin) 사용 | ||
| 예방 |
|
||
| 정의 | 라싸 바이러스(Lassa virus) 감염에 의한 급성 발열성·출혈성 질환1) | ||
|---|---|---|---|
| 질병분류 | 제1급 감염병(질병코드: A96.2) | ||
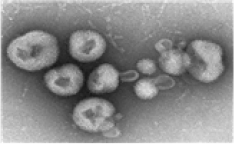
| 병원체 |
아레나바이러스과(Arenaviridae) 라싸 바이러스(Lassa virus) (두 개의 분절로 나뉘어진 단일가닥 RNA virus) |
|
|
| 주요 백신항원 | Envelope GPC(GP1, GP2) glycoprotein | ||
| 병원소 | 설치류 중 Mastomys natalensis | ||
| 감염경로 | 동물 → 사람 |
감염된 설치류(쥐) 직간접적 접촉/설치류 배설물(소변, 대변) 흡입 (섭취) 쥐 또는 쥐 배설물에 오염된 음식물 섭취 (접촉) 토양으로 흡수된 쥐의 배설물에 상처 난 피부나 점막 노출 (흡입) 쥐배설물에 오염된 바닥 청소과정에서 발생한 에어로졸 흡입 |
|
| 사람 → 사람 |
라싸열 환자·사망자의 혈액, 체액 접촉 (접촉) 상처 난 피부 점막에 환자의 혈액, 체액 직접 접촉 (접촉) 감염된 환자와 성 접촉 (접촉·흡입) 의료 환경에서 의료행위, 시술 중 노출되어 감염 전파 |
||
| 국내발생 | 국내 발생 없음 | ||
| 국외발생 | 최초보고 | 1969년 나이지리아 Borno 주 Lassa 지역에서 발생 보고 | |
| 발생동향 | 서아프리카 지역에서 건기(11월~5월)에 유행 발생 및 연중 산발적 발생 | ||
| 위험지역 | 베냉, 가나, 기니, 나이지리아, 라이베리아, 말리, 시에라리온, 부르키 나 파소, 코트디부아르, 토고 중앙아프리카공화국(그 외, 서아프리카 지역) | ||
| 해외유입 | 1969-2016년, 9개 국가에서 총 33건 (영국 13, 미국 8, 독일 5, 네덜란드 2, 캐나다 1, 이스라엘 1, 일본 1, 스웨덴 1, 남아프리카 1) | ||
| 잠복기 | 2-21일 | ||
| 임상 증상 |
|
||
| 치명률 |
감염자의 약 1∼3%, 입원환자에서는 15-20%* 각국의 보건의료체계 수준에 따라 다름(’15-’16년 나이지리아 유행시 치명률 32.6%) |
||
| 진단 | 검체(혈액, 체액 등)에서 특이 유전자 검출(Real-time RT-PCR) | ||
| 치료 | 전 세계적으로 상용화된 특이치료제 없음(대증치료) 다만, 증상 초기에 항바이러스제(리바비린) 투여 시 효과가 있는 것으로 알려져 있음 | ||
| 예방 |
|
||
| 라싸 바이러스 동물모델 | 장점 | 단점 |
|---|---|---|
|
Murine Models (Natalensis mastomys, IFNAR-/-, Chimeric IFNAR-/-B6, IFNαβ/γR-/-, STAT1-/-, CBA, HHD 등) |
|
|
|
Guinea Pig Models (Strain 13-inbred, Hartley-outbred 등) |
|
|
|
Non-Human Primate Models (Cynomolgus macaques, Rhesus monkey, Marmoset, Squirrel monkeys 등) |
|
|
| 정의 | 뎅기 바이러스(Dengue virus) 감염에 의한 급성 열성 질환1)2) | ||
|---|---|---|---|
| 질병분류 | 제3급 감염병(질병코드: A90.0, A91.0) | ||
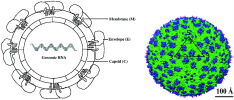
| 병원체 |
플라비바이러스과(Flaviviridae) 플라비바이러스속(Flavivirus) 뎅기 바이러스(Dengue virus) (양성 단일가닥 RNA 바이러스) |
|
|
| 주요 백신항원 | structural proteins(Premembrane(prM), Envelope(E)) | ||
| 병원소 | 숲모기류 (흰줄 숲모기 Aedes albopictus or 이집트 숲모기 Aedes aegypti), 사람 | ||
| 감염경로 | 숲모기 ↔ 사람 |
뎅기 바이러스에 감염된 매개모기에 물려 감염 전파 뎅기 바이러스에 감염되어 발열이 지속되는 사람을 흡혈 시 매개체(모기)에게 바이러스 전파 가능 |
|
| 사람 ↔ 사람 | 수혈, 성접촉, 태반, 모유 등 | ||
| 국내발생 | 2000년에 법정감염병으로 지정되었으며, 자체 국내발생 사례는 없음. | ||
| 국외발생 | 최초보고 | 뎅기 바이러스의 정확한 발생시기는 알기 어렵지만, 중국 진나라 시대(265~420년)에 발간된 책이 있을 정도로 오래 전부터 존재 | |
| 발생동향 | 전 세계 100여개 이상의 국가에서 발생, 풍토지역은 주로 열대와 아열대지방에 걸쳐 적도를 기준으로 남북 위도 35°까지 매우 광 범위함, 뎅기열을 전파시키는 모기가 주로 고인 물에서 번식하기 때문에 우기에 환자가 급증함 | ||
| 위험지역 | |||
| 해외유입 | 해외유입으로 인한 국내 신고현황 : 2013-2019년 평균 227명, 2020년 43명, 2021년 3명, 2022년 104명 | ||
| 잠복기 | 5-7일 | ||
| 임상 증상 |
|
||
| 치명률 | 조기에 치료 시 1%, 치료시기가 늦을 경우 약 20% | ||
| 진단 | 검체(혈액, 체액 등)에서 특이 유전자 검출(Real-time RT-PCR) | ||
| 치료 | 전 세계적으로 특화된 치료제 없어 증상에 따른 대증치료가 최선 | ||
| 예방 |
|
||
| 뎅기 바이러스 동물모델 | 장점 | 단점 |
|---|---|---|
|
Murine Models (C57BL/6 and BALB/c mice, AG129 mice, Humanized mice) |
|
|
| NHP (Rhesus macaques, Cynomolgus macaques, Marmoset, Bonnet macaque, Chimpanzee) Models |
|
|
|
Swine Models (Yucatan miniature pig) |
|
|
| Tree shrew Models |
|
|