감염병 진단검사의 신뢰도를 강화하기 위해 노력합니다.
- 감염병 진단검사는 격리・치료 등 방역 대응의 첫 단계로 정확성의 확보가 매우 중요합니다.
- 이에 질병관리청은 공공 검사기관의 감염병 진단검사 능력을 유지 및 관리하기 위해 다양한 노력을 하고 있습니다.
- 감염병 실험실 검사법에 대한 표준절차서(Standard Operating Procedure; SOP)를 마련
- 전국에서 동일하게 감염병 진단검사를 수행할 수 있도록 검증이 완료된 표준검사법을 지자체에 기술이전
- 기술 이전된 표준검사법에 대해 매년 교육 및 숙련도평가를 실시하여 검사 정확도 관리
- 검사의 질관리를 위한 표준물질을 생산 및 배포
- 표준 체계 운영 역량이 객관적으로 입증된 실험실을 ‘감염병 국가표준실험실’로 인정 및 관리하여 감염병 진단검사 체계의 표준화를 추진
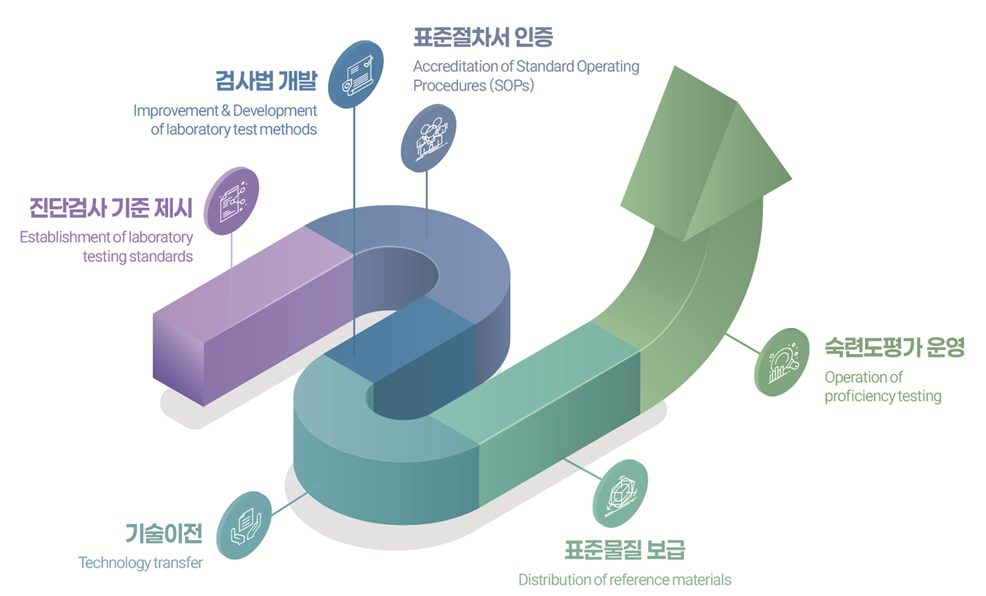
이 이미지는 진단검사 품질관리의 단계별 절차를 곡선형 화살표로 표현한 흐름도이다.
시작 단계
- 진단검사 기준 제시: 검사 기준 및 표준 설정.
- 검사법 개발: 실험실 검사법의 개선 및 개발.
중간 단계
- 표준절차서 인증(SOPs): 검사 수행을 위한 표준운영절차를 마련하고 인증.
- 기술이전: 개발된 기술을 관련 기관이나 실험실로 이전.
심화 단계
- 표준물질 보급: 기준이 되는 표준물질을 배포하여 검사 신뢰성 확보.
- 숙련도평가 운영: 검사기관의 숙련도 평가를 통해 품질 유지와 개선.
종합 해석
전체 과정은 기준 수립 → 검사법 개발 → 절차 인증 → 기술 확산 → 표준물질 보급 → 숙련도평가 순으로 이어지며,
궁극적으로 실험실 진단검사의 신뢰성과 정확성을 보장하는 품질관리 체계임을 나타낸다.
시작 단계
- 진단검사 기준 제시: 검사 기준 및 표준 설정.
- 검사법 개발: 실험실 검사법의 개선 및 개발.
중간 단계
- 표준절차서 인증(SOPs): 검사 수행을 위한 표준운영절차를 마련하고 인증.
- 기술이전: 개발된 기술을 관련 기관이나 실험실로 이전.
심화 단계
- 표준물질 보급: 기준이 되는 표준물질을 배포하여 검사 신뢰성 확보.
- 숙련도평가 운영: 검사기관의 숙련도 평가를 통해 품질 유지와 개선.
종합 해석
전체 과정은 기준 수립 → 검사법 개발 → 절차 인증 → 기술 확산 → 표준물질 보급 → 숙련도평가 순으로 이어지며,
궁극적으로 실험실 진단검사의 신뢰성과 정확성을 보장하는 품질관리 체계임을 나타낸다.
- 01 과학적 근거에 빠른 진단검사 기준 제시
Provision of laboratory testing standards based on scientific evidence
- 02 객관적 검증을 통한 감염병 진단검사법 개발
Establishment of SOPs for laboratory testing through validation
- 03 검사법 교육 및 평가를 통한 기술이전
Technology transfer through training and assessments of test methods
- 04 정확한 진단검사 시행을 위한 숙련도평가 운영
Operation of proficiency testing for accurate laboratory testing

